この記事では爆発限界に関する法則(バージェスホイラーの法則、ルシャトリエの法則)、爆発限界に影響する条件について紹介します。
バージェスホイラーの法則
飽和炭化水素の爆発限界に関する法則です。これは、爆発下限界濃度L[%]と燃焼熱Qc[kJ/mol]の積はほぼ一定であるという法則です。式で表すと以下のようになります。
LQc = K
この法則を利用し、飽和炭化水素の爆発下限界を求めてみます。エタンとプロパンの燃焼熱はそれぞれ、1429[kJ/mol]、2043[kJ/mol]であり、エタンの爆発下限界は3.0%であることから、プロパンの爆発下限界Lpは以下の式で求められます。
3.0×1429 = Lp×2043
上記の計算結果から、Lpは2.1[vol %]となります。
しかし、このような法則は爆発上限界に関しては規則性はありません。その理由は、上限界側では酸素不足のため、不完全燃焼生成物のほか、分解や重合なども進み複雑な反応になるためです。
また、このバージェスホイラーの法則は、相互に類似した複数のガスの混合系の下限界濃度を推定するために用いることができて、その過程からルシャトリエの法則が導かれます。
ルシャトリエの法則
それぞれL1、L2、L3・・・の爆発下限界濃度[vol%]をもつようなガスがC1、C2、C3・・・の濃度[vol%]で混合している場合、混合ガスの爆発下限界濃度L[vol%]はルシャトリエの法則から、以下のように表されます。
100/L = C1/L1+C2/L2+C3/L3・・・
主要ガスの爆発限界と爆ごう限界及び引火点、発火点をまとめた表をと上記の式を利用して、混合ガスの爆発下限界濃度を計算してみます。
メタン、エタン、プロパンがそれぞれ50 vol%、30 vol%、20 vol%ずつ含まれる混合ガスの常温・大気圧条件下での爆発下限界を求めることとします。問題で設定された条件と、下の表からLは以下の式で計算できます。
100/L=50/5.0+30/3.0+20/2.1
この式を解くと、L=3.4 vol% となります。
爆発限界の温度依存性
爆発下限界の温度依存性に関する式は以下の式となります。
Lt/L25 = 1 – 0.000721(t – 25)
ここで、LtおよびL25はそれぞれ温度t ℃および25℃の下限界濃度です。計算例として、300℃での水素の爆発下限界を考えて見ます。25℃での水素の爆発下限界は4%なので
Lt/4 = 1 – 0.000721(300 – 25)
Lt = 3.21 %
2割ほど爆発下限界が下がることがわかりました。この式で重要なのは、温度が上がると爆発下限界は下がる、すなわち爆発範囲が広がってしまうことです。実業務では、少なくとも温度が上がると爆発範囲は広がることは頭に入れておく必要があります。
爆発限界の圧力依存性
爆発限界の圧力依存性は温度依存性のように単純ではなく、一般に飽和炭化水素類の爆発限界は圧力の増加に伴って広くなりますが、混合系によっては狭くなるものもあり、複雑な挙動をとります。下に水素、空気系混合気の爆発限界に及ぼす加圧の影響を示します。圧力の増加に伴って一旦爆発限界は狭くなりますが、さらに加圧すると爆発限界は広くなり、やがて圧力には依存しないようになります。
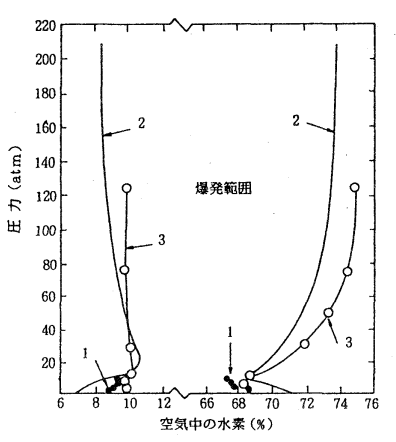
(1,2:筒状容器の下方伝播、 3:球形容器)
https://www.jstage.jst.go.jp/article/nikkashi1972/1992/12/1992_12_1492/_pdf/-char/ja
不活性ガスによる希釈効果
燃焼反応の立場からみると、すべての気体は次の3種の成分に分類できます。
①可燃性成分、②支燃性成分、③不活性成分
ガス混合物の爆発を起こす組成域(爆発範囲)を検討する上で、上記3種の成分の組合せで最も基本
となる系は、可燃性成分-支燃性成分-不活性成分の系です。ここで、この3成分系の爆発範囲の基本
形を以下に示します。
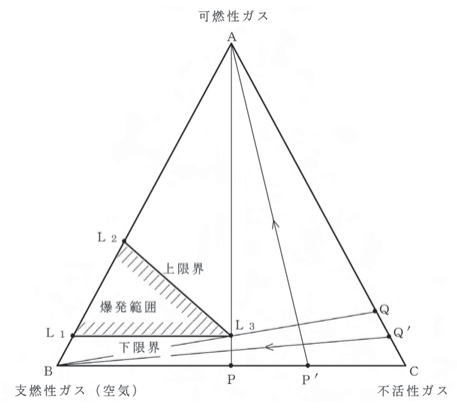
図において、爆発範囲L1L2L3は三角形状になります。このとき、L3点を爆発臨界点と呼びます。操業中の反応器や貯槽のような密閉容器中で、爆発性混合物が常時形成することを防ぐために、しばしば実施されている不活性ガス置換法があります。一般に、可燃性物質-空気-不活性ガスの3成分系では、酸素濃度をある限界値以下に保持すれば、もはや爆発を生じなくなります。また、AC辺に平行で爆発臨界点L3に接する直線を引けば、この線上の酸素濃度(一定値)が爆発限界酸素濃度となります。
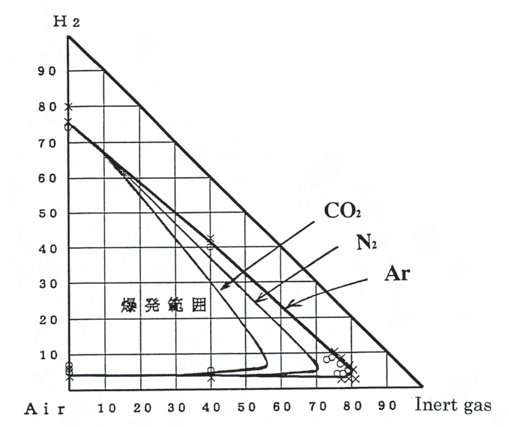
この系の一例として、水素-空気-不活性ガス(二酸化炭素、窒素及びアルゴン)3成分系の爆発範囲の測定結果を示します。希釈ガスの消炎効果は、単原子分子(Ar)、2原子分子(N2)、3原子分子(CO2)の順で大きくなります。これは多原子分子になるほどその比熱が大きくなるため火炎の冷却効果も大きくなるためです。また、下限界濃度は不活性ガスの希釈によっても余り変わりません。これは下限界では多少希釈しても酸素が十分にあるからです。
以下に三角図をエクセルで書く方法についてまとめてあるサイトのリンクを貼っておきます。自分で色々書いてみるとイメージが付きやすいと思います。
最後に
この記事では爆発限界に関する法則(バージェスホイラーの法則、ルシャトリエの法則)、爆発限界に影響する条件について紹介しました。この内容は高圧ガスの試験だけでなく、業務の中でも役立つので、確実に押さえておくべき内容です。
ご安全に!


コメント