ボイラーの運転管理の中でも重要な水質管理。特に貫流ボイラーをはじめとする水管ボイラーでは特に重要となります。
しかし、一口に水質といっても様々な指標があり、それが何を意味しているか、運転にどう影響するかって意外とわかりにくくないですか?今回はそんなお悩み解消の力になりたいと思います。
なぜ水質管理が必要か?
一般的に、ボイラに使用する原水(河川水、地下水、工業用水、水道水など)の中には、カルシウムイオン(Ca2+)、マグネシウムイオン(Mg2+)ならびにシリカ(SiO2)などのスケール障害の原因となる成分や、溶存酸素(O2)などの腐食障害の原因となる成分など、様々な物質が溶解しています。また、塩類濃度の高い水や油脂分が混入した水はキャリーオーバー障害の原因になります。これらの障害を防止するため、それぞれのボイラにあった最適な水処理を行う必要があります。(キャリーオーバーやスケール、スラッジについては別途記事にします。)
ボイラの水質管理は、まず、ボイラの型式、圧力、補給水種、運転条件などにより、給水およびボイラ水の水質管理目標値を設定し、次に、目標水質を維持するための水処理方式や、最適な処理薬品とその添加量、ブロー率などを決定します。その後も、定期的な水質分析や、ボイラの開缶調査などにより、適時、水処理方式や水質管理目標値、処理薬品と添加量、ブロー率等の見直しを行うことが大切です。
自分の担当プラントでは週に1回、薬剤メーカーに分析を依頼しており、その結果を基に薬剤の添加量やブロー量を調整しています。また、定修時にチューブが減肉していることが判明したので、その原因を調査したところ、水質調整に使っていた薬剤が原因でした。そのため、薬剤の変更が過去に行われていました。
pH
ボイラ水のpHは、腐食の抑制及びスケールの付着防止を目的として管理する項目です。pHは、ボイラ水のアルカリ成分(NaOH,NaCO3,NaHCO3,Na3PO4及びNa2HPO4)の濃度を表す指標となります。ボイラ水のアルカリ成分は、給水が持ち込むカルシウム、マグネシウム及びシリカと反応して,カルシウム及びマグネシウムは懸濁状のりん酸塩[水酸化トリス(りん酸)五カルシウム,Ca5(OH)(PO4)3]及び水酸化物[水酸化マグネシウム,Mg(OH)2]を生成させ、シリカはメタけい酸イオン(SiO32−)として溶存されるので,スケール化を防止することができます。また、ボイラ水のマグネシウム(Mg2+)は、pH 11以上では硬質のスケールであるけい酸マグネシウム(MgSiO3)を生成するよりも、主として水酸化イオン(OH−)と反応して懸濁状(又は浮遊状)の水酸化マグネシウム[Mg(OH)2]となり、ボイラの底部に堆積するか、又はブローでボイラ外に排出することによって伝熱面上でのスケール化を防止することができます。
硬度
硬度とは水中のカルシウムイオンとマグネシウムイオンの総量を示します。硬度がボイラ内に流入するとボイラ内壁にスケールとして付着します。スケールは断熱材と同様な挙動をしますので、熱効率の低下や過熱等による焼損を発生します。
酸消費量
酸消費量は水中に含まれるアルカリ成分(炭酸水素塩、炭酸塩、水酸化物など)の量を、これに相当する炭酸カルシウムの濃度に換算して表したものです(単位:mgCaCO3/L)。
ボイラ水には酸消費量の基準値があり、ボイラ水のpHを基準内に保持し、さらにシリカスケール生成を抑制するため決められており、これには「酸消費量(pH4.8)」と「酸消費量(pH8.3)」があります。
① 酸消費量(pH8.3)
酸消費量(pH8.3)は水溶液のpHを8.3よりも高くしている物質の濃度を表しています。通常の水道水はpH7付近ですので、水道水では酸消費量(pH8.3)は0になります。
一般的に酸消費量(pH8.3)はシリカに対して1.7倍以上必要とされており、シリカを溶解状態に保持し、スケール化を抑制します。酸消費量(pH8.3)は以前P-アルカリ度とも呼ばれていましたが、これは測定指示薬のフェノールフタレインの頭文字のPを取ったものです。現在ではJIS規格で呼び名を酸消費量(pH8.3)に統一されています。
② 酸消費量(pH4.8)
酸消費量(pH4.8)は水溶液のpHを4.8よりも高くしている物質の濃度を表しています。ボイラの給水(原水)では必ず測定されます。
酸消費量(pH4.8)はM-アルカリ度とも呼ばれていましたが、これは測定指示薬のメチルオレンジの頭文字のMを取ったものです。現在ではJIS規格で呼び名を酸消費量(pH4.8)に統一されています。
全固形物
全固形物(全蒸発残留物)は、水中に溶解、懸濁している成分の総量です。
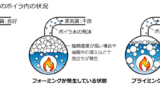
ボイラに流入した給水は、水は蒸気となり系外へ出ますが、給水中に溶解している成分はボイラ内に残ります。全固形物の量が多くなると、ボイラ内の水面変動が激しくなります。このような場合、給水ポンプの発停が頻繁になったり、湿り気の多い蒸気が供給(キャリーオーバー)されたりします。そのため全固形物を一定の値以下になるように、ボイラ水を定期的に排出する必要があります。
電気伝導率
電気伝導率は電気の通りやすさを示すものであり、水溶液中に含まれるイオンが多ければ多いほど電気を通すことから、水中の溶解固形物の量を知ることが出来ます。
ボイラ水には電気伝導率の基準値があります。これは全固形物と密接な関係にあり、電気伝導率が大きいときは、全固形物の量も多いということになります。
ボイラ水において、全固形物と電気伝導率とはpH値にもよりますが、概ね次の関係式があります。
全固形物(mg/L) ≒ 7×電気伝導率(mS/m)
但し、懸濁している固形物がない場合です。懸濁成分は溶解(イオン化)していませんので、電気を運ぶことが出来ません。そのため電気伝導率が低くても全固形物は高いことがあります。
また、シリカが多い場合も同様で、シリカは電気を通しにくいため電気伝導率が低くても、シリカが高くなっている場合があります。
塩化物イオン
ボイラ水の塩化物イオンは、腐食を抑制する目的で管理するとともに、ボイラ水の濃縮の程度を知る目的で管理する項目です。塩化物イオンは、火力発電プラントの各系統の水中において沈殿物を生成しないで、常に溶存していることから、ボイラ水及び給水の塩化物イオンの濃度を測定すれば、ボイラ水の濃縮倍数が推定できます。また、塩化物イオンは、鋼面の酸化鉄の防食皮膜の安定性を阻害するため、なるべく低濃度に維持することが望ましいです。
りん酸イオン
アルカリ処理及びりん酸塩処理を適用しているボイラ水中に存在します。りん酸イオンは,ボイラの腐食防止の機能、並びに丸ボイラ及び特殊循環ボイラで硫酸カルシウムなどの硬質のスケールの付着を防止する機能があります。 ボイラ水中でのカルシウムとりん酸イオンとの反応は
5Ca2++OH−+3PO43− → Ca5(OH)(PO4)3
であり、炭酸カルシウムCaCO3: 1 mg/L当たり必要なりん酸イオンは,PO4: 0.57 mg/Lです。 丸ボイラ・水管ボイラのボイラ水の水質管理値では、りん酸イオンの濃度をPO4: 20〜40 mg/Lとしていますが,不測の硬度成分の漏れに対処するためには,上限付近で管理することが必要となります。
近年、閉鎖性水域での富栄養化の概念からりんの排水規制が強化され、ボイラ水処理においても、りんを使用しない処理が年々増加の傾向となっています。
シリカ
天然水中のシリカは、イオン状、コロイド状及び懸濁状の三つの形態で存在します。イオン状のシリカはpH 1.1〜1.6で七モリブデン酸六アンモニウムと反応して黄緑のヘテロポリ酸(ドデカモリブドけい酸)を生じます。
コロイド状のシリカは,弱アルカリ性で加熱するとイオン状シリカに変わりますが肉眼では透明でコロイド粒子は確認できません。
懸濁状のシリカは,微細の土壌成分(不溶性のけい酸塩),微生物(けい藻類)などの濁り成分中のシリカである。
全シリカは,これら三つの形態のシリカの合計をいいいます。規格本体のシリカはイオン状のシリカの濃度を示しています。
ボイラ水はアルカリ性で、かつ高温であるため、コロイド状及び懸濁状のシリカは加水分解して、イオン状のシリカに変わる。したがって,ボイラ水中のシリカの濃度を、ボイラ給水中のシリカの濃度と濃縮倍数との関係(給水量及びブロー量)から見た場合、濃縮倍数が低いにもかかわらず,ボイラ水中のシリカの濃度が高いのは、コロイド状及び懸濁状のシリカの混入によるものです。
なお、懸濁状のシリカは凝集沈殿・ろ過処理で除去することができますが,コロイド状のシリカを凝集させるのは難しいです。また、イオン状のシリカは強塩基性陰イオン交換樹脂を用いたイオン交換処理で除去可能です。
最後に
今回は各評価指標について紹介しました。これに関連して、各評価指標の変動要因である水中の不純物等を他の記事で紹介していきます!
ご安全に!
参考
http://www.n-thermo-c.co.jp/vol.2.html
https://kcr.kurita.co.jp/wtschool/068.html


コメント